QUEM SOMOS NÓS
PIBID é o programa de iniciação à docência, desenvolvido nas escolas com intuito de fazer com que os acadêmicos adquiram maior experiência na área do ensino de Química.
PIBID QUÍMICA - UNIPAMPA
Coordenador do Sub-Projeto Química:
Profa. Débora Figueredo Gay
Coordenador do Sub-Projeto Química:
Profa. Débora Figueredo Gay
Profa. Renata Hernandez Lindemann
Atua nas escolas:
Colégio Estadual de Ensino Médio Waldemar Amoretty
Integrantes:
- Prof. Gisele Brites;
Atua nas escolas:
Colégio Estadual de Ensino Médio Waldemar Amoretty
Integrantes:
- Prof. Gisele Brites;
- Bruna J. Leite
- Julia E. Mello;
- Juliane L. Ferreira;
- Natália B. Alves;
- Roberto L. Lima
- Tassiéllen S. Antunes.
Escola Estadual de Ensino Fundamental e Médio Silveira Martins
Integrantes:
- Prof. Clarissa M. Sousa;
- ;
- Milena S. Esmério;
- Elisabeti S. Cougo;
- Juliana O. Ehlers,
- Taís B. Goulart.
- Julia E. Mello;
- Juliane L. Ferreira;
- Natália B. Alves;
- Roberto L. Lima
- Tassiéllen S. Antunes.
Escola Estadual de Ensino Fundamental e Médio Silveira Martins
Integrantes:
- Prof. Clarissa M. Sousa;
- ;
- Milena S. Esmério;
- Elisabeti S. Cougo;
- Juliana O. Ehlers,
- Taís B. Goulart.
Blogs Importantes
-
-
Bem Vindos!Há 15 anos
-
-
-
AnsiedadeHá 7 anos
Seguidores
Curiosidades
Carvão e Diamante, o que os difere?
Carvão e diamante são substâncias que têm a mesma composição, mas valores extremamente diferentes. Imagine só fazer joias usando carvão ou acender uma lareira colocando diamantes para queimar, não seria absurdo?
Na verdade, a semelhança entre diamante e carvão limita-se apenas ao fato de que o carvão é um mineral rico em carbono e os diamantes também são feitos de carbono.
E por que o diamante possui valor tão alto, ao contrário do carvão, que é simplesmente queimado?Vejamos as diferenças no processo de formação:
E por que o diamante possui valor tão alto, ao contrário do carvão, que é simplesmente queimado?Vejamos as diferenças no processo de formação:
Os diamantes são obtidos sob altíssimas pressões a partir do magma presente no interior da Terra (bem abaixo da crosta). Foram necessários vários séculos para que camadas de magma fossem sendo depositadas umas sobre as outras, acarretando em forte pressão. O magma foi sendo comprimido até se petrificar. O resultado você já sabe, diamantes belos, duráveis e muito valiosos.
Já o carvão surge de um processo bem mais simplificado e acessível, ele é obtido a partir da decomposição de folhas, vegetação e árvores. O local escolhido é embaixo da terra, onde as temperaturas se elevam em relativa pressão. O carvão é formado a partir das mudanças físicas e químicas propícias a essas condições, num tempo bem inferior ao que origina o diamante.
Portanto, não seria possível ambas substâncias possuírem o mesmo valor comercial, uma vez que o tempo de formação se difere nos dois processos.
Como funciona o Bafômetro
O bafômetro é um aparelho que permite determinar a concentração de bebida alcoólica analisando o ar exalado dos pulmões de uma pessoa. É também conhecido pela denominação técnica “etilômetro”, devido às reações que envolvem o álcool etílico presente na baforada do suspeito e um reagente.
Todos os tipos de bafômetros são baseados em reações químicas, e os reagentes mais comuns são dicromato de potássio e célula de combustível. A diferença entre estes dois reagentes é que o dicromato muda de cor na presença do álcool enquanto a célula gera uma corrente elétrica.
O mais usado pelos policiais no Brasil é o de Célula de combustível, a química deste bafômetro você vê a seguir:
1. O álcool expirado reage com o oxigênio presente no aparelho, esta reação ocorre com a ajuda de um catalisador;
2. Ocorre a liberação de elétrons, de ácido acético e de íons de hidrogênio;
3. Os elétrons então passam por um fio condutor, gerando corrente elétrica. Um chip presente dentro do aparelho calcula a porcentagem e dá a concentração de álcool no sangue. Quanto mais álcool, maior será a corrente elétrica.
O mais usado pelos policiais no Brasil é o de Célula de combustível, a química deste bafômetro você vê a seguir:
1. O álcool expirado reage com o oxigênio presente no aparelho, esta reação ocorre com a ajuda de um catalisador;
2. Ocorre a liberação de elétrons, de ácido acético e de íons de hidrogênio;
3. Os elétrons então passam por um fio condutor, gerando corrente elétrica. Um chip presente dentro do aparelho calcula a porcentagem e dá a concentração de álcool no sangue. Quanto mais álcool, maior será a corrente elétrica.
E não existem desculpas para se negar a fazer o teste, como por exemplo:
- Recusar a soprar o canudinho por ele estar contaminado: ele é descartável e tem uma válvula que impede que o ar de dentro volte para sua boca;
- Dizer que não consegue assoprar? É preciso 1 litro e meio de ar para fazer a medição, é o equivalente a um sopro de cinco segundos.
E mais, não adianta tentar disfarçar o hálito, mascar chicletes, tomar azeite, etc, todas essas artimanhas não o impedirão de perder a carteira e ter o veículo apreendido.
- Recusar a soprar o canudinho por ele estar contaminado: ele é descartável e tem uma válvula que impede que o ar de dentro volte para sua boca;
- Dizer que não consegue assoprar? É preciso 1 litro e meio de ar para fazer a medição, é o equivalente a um sopro de cinco segundos.
E mais, não adianta tentar disfarçar o hálito, mascar chicletes, tomar azeite, etc, todas essas artimanhas não o impedirão de perder a carteira e ter o veículo apreendido.
De que é composta a pasta dental?
Você já teve a dúvida: Qual a composição da pasta dental? É importante saber quais substâncias são responsáveis pela proteção de seus dentes e de livrá-lo do famoso “bafo de onça” ao acordar.
A composição dos cremes dentais pode variar de uma marca para outra, mas precisa conter os ingredientes abaixo para garantir uma boca saudável e um hálito fresco:
Carbonato de cálcio (CaCO3): uma das substâncias abrasivas, elas agem durante a escovação aumentando o atrito com os dentes. Esta ação promove uma espécie de esfoliação da camada mais externa dos dentes, retirando toda a placa bacteriana.
Fluoreto de sódio (NaF): este é o protetor do esmalte dental, o flúor se combina com o fosfato de cálcio presente nos dentes e dá origem à fluoropatita. Essa substância garante maior proteção contra cáries dentárias, pois inibe a ação de bactérias.
Sorbitol - C6H8 (OH)6: essa substância é responsável pelo sabor doce da nossa pasta dental.
Esses são os principais componentes que agem sobre seus dentes na hora da escovação. Agora você já sabe como proteger sua boca com a ajuda de substâncias químicas!
A composição dos cremes dentais pode variar de uma marca para outra, mas precisa conter os ingredientes abaixo para garantir uma boca saudável e um hálito fresco:
Carbonato de cálcio (CaCO3): uma das substâncias abrasivas, elas agem durante a escovação aumentando o atrito com os dentes. Esta ação promove uma espécie de esfoliação da camada mais externa dos dentes, retirando toda a placa bacteriana.
Fluoreto de sódio (NaF): este é o protetor do esmalte dental, o flúor se combina com o fosfato de cálcio presente nos dentes e dá origem à fluoropatita. Essa substância garante maior proteção contra cáries dentárias, pois inibe a ação de bactérias.
Sorbitol - C6H8 (OH)6: essa substância é responsável pelo sabor doce da nossa pasta dental.
Esses são os principais componentes que agem sobre seus dentes na hora da escovação. Agora você já sabe como proteger sua boca com a ajuda de substâncias químicas!
Onde está o fósforo? Na caixinha, ou no palito?
A dúvida que pode deixar sua cabeça pegando fogo: Onde está o fósforo: na caixinha ou no palito? Estamos acostumados a ouvir a expressão “palito de fósforo”, e foi justamente ela a culpada pela ideia errônea de que na pontinha vermelha dos recortes de madeira, haveria fósforo.
Saiba agora que o elemento fósforo (P) não está presente dentro da caixinha (palitos) e sim do lado de fora. A superfície onde riscamos o palito parece uma lixa, nela estão presentes as substâncias: dextrina, fósforo vermelho, Sb2S3 (trissulfeto de antimônio) e vidro moído. O atrito é provocado pela presença do vidro, é ele quem aciona a reação de combustão entre os componentes.
Na ponta do palito estão as substâncias alúmen e K2Cr2O7 (cromo hexavalente), a presença do Cromo é responsável pela coloração vermelha.
Saiba agora que o elemento fósforo (P) não está presente dentro da caixinha (palitos) e sim do lado de fora. A superfície onde riscamos o palito parece uma lixa, nela estão presentes as substâncias: dextrina, fósforo vermelho, Sb2S3 (trissulfeto de antimônio) e vidro moído. O atrito é provocado pela presença do vidro, é ele quem aciona a reação de combustão entre os componentes.
Na ponta do palito estão as substâncias alúmen e K2Cr2O7 (cromo hexavalente), a presença do Cromo é responsável pela coloração vermelha.
Obtenção e uso do silicone
Silicones são polímeros compostos por silício e oxigênio intercalados, contendo também grupos orgânicos na sua estrutura.
O silicone foi inventado em 1943, acompanhe as reações do processo de fabricação:
O silicone foi inventado em 1943, acompanhe as reações do processo de fabricação:
Observe que a areia (SiO2) misturada a carbono dá origem ao produto final, o silicone. A cadeia respectiva apresenta, em sua cadeia linear, átomos de silício e oxigênio alternados. A quantidade de ramificações orgânicas – CH3 pode variar na molécula, daí a explicação para a variedade de silicones existente no mercado.
O silicone pode variar de líquido viscoso a sólido, semelhante à borracha. Essa variação na forma física depende do tamanho da molécula, vejamos:
- O silicone formado por moléculas menores possui um aspecto oleoso, sendo por isso usado como impermeabilizante de superfícies, graxa lubrificante, cera de polimento, etc. Se encontra na forma líquida e pode ser aplicado para realçar o para-choque e painéis plásticos de automóveis.
- Moléculas intermediárias dão origem a silicones mais pastosos, usados na fabricação de adesivos e selantes, como, por exemplo, colas de silicone, usadas na montagem e fixação de aquários e janelas de vidro.
- À medida que a parte orgânica da molécula de silicone fica maior, as ligações se cruzam e o silicone assume o aspecto de elastômero, mais conhecido como borracha de silicone. Assim, passa a apresentar alta resistência e por isso é aplicado em equipamentos industriais e peças de automóveis, dentre outras.
Para quem associa a palavra silicone apenas à vaidade feminina de obter seios maiores (próteses siliconadas), apresentamos aqui outra aplicação deste polímero no universo feminino: o silicone é usado em formulações cosméticas, como por exemplo, em batons.
Adrenalina
A adrenalina é um hormônio liberado pelas glândulas que ficam sobre os rins (glândulas suprarrenais). A presença no organismo se dá através de um sinal liberado em resposta ao grande estresse físico ou mental, situações de forte emoção como, por exemplo: descida em montanha russa, salto de paraquedas, esportes radicais em geral.
.jpg)
Estrutura molecular da Adrenalina
A adrenalina atua como um neurotransmissor que tem efeito sobre o sistema nervoso simpático, preparando o organismo para um grande esforço físico. Os sintomas característicos da liberação de adrenalina são: suor, vasoconstrição, aumento dos batimentos cardíacos, dilatação das pupilas e brônquios (aumenta a visão e deixa a respiração ofegante), eleva o nível de açúcar no sangue, entre outros.
A adrenalina pode ocasionar a morte?
O aumento dos batimentos cardíacos faz com que o sangue seja bobeado mais rapidamente, esse efeito só ocorre por que os vasos se contraem ficando mais finos (vasoconstrição), acelerando a circulação sanguínea. O problema é que, se alguma artéria que leva sangue ao coração estiver um pouco entupida, o estreitamento agravará o quadro: o sangue não circula e então ocorre a morte de um conjunto de células por falta de oxigênio, mais conhecido como infarto.
Como se vê, a Adrenalina recebe duas classificações: hormônio e neurotransmissor, mas se tratando das classes orgânicas, ela se caracteriza como Amina (presença de NH2).
.jpg)
Adrenalina
Fique sabendo agora a origem da palavra Adrenalina!
O neurotransmissor foi nomeado como "adrenalina" pelo cientista que conseguiu isolá-lo pela primeira vez, o bioquímico japonês Jokichi Takamine. Ele se inspirou na localização do hormônio no organismo:ad- (prefixo que indica proximidade), renalis (relativo aos rins) e o sufixo -ina, (referente a classe pertencente, às aminas).
O neurotransmissor foi nomeado como "adrenalina" pelo cientista que conseguiu isolá-lo pela primeira vez, o bioquímico japonês Jokichi Takamine. Ele se inspirou na localização do hormônio no organismo:ad- (prefixo que indica proximidade), renalis (relativo aos rins) e o sufixo -ina, (referente a classe pertencente, às aminas).
Duro como diamante
Até pouco tempo, o diamante era conhecido como o material mais duro existente na natureza. Mas a evolução das pesquisas científicas, ao lado das sínteses em laboratório, deu origem a um material que ameaça possuir uma dureza mais elevada do que a do então conhecido diamante. A enigmática descoberta tem em sua composição cristais de nitreto de carbono. Na verdade, esse material já vem sendo pesquisado desde os anos 80. Nesta época, o nitreto de beta-carbono (beta-C3N4) chamou a atenção de um cientista norte-americano para o cálculo da dureza das substâncias, e o resultado comprovou se tratar de algo muito duro.
O método usado pelos atuais cientistas se baseia na junção de nitreto de titânio e nitreto de carbono, ambos materiais duros, mas o composto resultante possui dureza duas vezes maior do que cada material isolado.
A substância que deseja tomar o lugar do diamante, na forma sólida e de cor levemente rosa, ainda precisa dar alguns passos para garantir sua consistência e, é claro, a beleza única, para ser dura e procurada como o tradicional diamante.
Elementos de transição na Tabela Periódica
Elementos de transição também são conhecidos como Metais de transição. O nome é apropriado, uma vez que as propriedades destes elementos são intermediárias entre os elementos metálicos, que ficam à esquerda da Tabela (metais Alcalinos e Alcalino-terrosos), e os elementos não metálicos.
Os membros da Tabela Periódica que fazem parte desta denominação se classificam em Elementos de transição interna ou externa, como na tabela abaixo:

Repare que os metais de transição se referem aos elementos pertencentes aos grupos 3 ao 12 (na cor verde), localizados no centro da Tabela.
Elementos de transição externa - se apresentam em três níveis:
Primeira série de transição: titânio, vanádio, cromo, manganês, ferro, cobalto, níquel e cobre.
Segunda série de transição: zircônio, nióbio, molibdênio, tecnécio, rutênio, ródio, paládio e prata.
Terceira série de transição: háfnio, tantálio, tungstênio, rênio, ósmio, irídio, platina e ouro.
Esses elementos possuem, em geral, os orbitais de valência 3d, 4d e 5d (subníveis mais energéticos).
Elementos de transição interna (ou somente Elementos de transição):
Lantanídeos: elementos que vão desde o número atômico 57 até o 71.
Actinídeos: elementos que vão desde o número atômico 89 até o 103.
Os lantanídeos e os actinídeos possuem orbitais de valência 4f e 5f.
Os elementos de transição, tanto os internos como os externos, são metais e possuem alta condutividade térmica e elétrica.
Os membros da Tabela Periódica que fazem parte desta denominação se classificam em Elementos de transição interna ou externa, como na tabela abaixo:

Repare que os metais de transição se referem aos elementos pertencentes aos grupos 3 ao 12 (na cor verde), localizados no centro da Tabela.
Elementos de transição externa - se apresentam em três níveis:
Primeira série de transição: titânio, vanádio, cromo, manganês, ferro, cobalto, níquel e cobre.
Segunda série de transição: zircônio, nióbio, molibdênio, tecnécio, rutênio, ródio, paládio e prata.
Terceira série de transição: háfnio, tantálio, tungstênio, rênio, ósmio, irídio, platina e ouro.
Esses elementos possuem, em geral, os orbitais de valência 3d, 4d e 5d (subníveis mais energéticos).
Elementos de transição interna (ou somente Elementos de transição):
Lantanídeos: elementos que vão desde o número atômico 57 até o 71.
Actinídeos: elementos que vão desde o número atômico 89 até o 103.
Os lantanídeos e os actinídeos possuem orbitais de valência 4f e 5f.
Os elementos de transição, tanto os internos como os externos, são metais e possuem alta condutividade térmica e elétrica.
Excitação Eletrônica
A excitação dos elétrons produz energia capaz de gerar luz: é o fenômeno chamado de fluorescência.
Você já usou pulseiras de Neon? Nas festas de casamento, formaturas, festas em geral, elas se tornaram a sensação do momento, encantando as pessoas pela luz que emitem em meio à penumbra das boates. Essas luzes equivalem à fluorescência do gás Neon (Ne, décimo elemento da tabela periódica, do grupo dos gases nobres) mediante a passagem de uma corrente elétrica.
O Neon é obtido do ar atmosférico pelo processo da liquefação fracionada e é muito utilizado comercialmente. O processo de obtenção consiste no resfriamento do ar até que esse fique liquefeito gradativamente e preparado para aquecer. Os chamados luminosos de Neon são muito usados na publicidade: iluminação de anúncios comerciais, em letreiros luminosos com o intuito de chamar a atenção do público, basta olhar para a cidade à noite que veremos luzes de Neon.
Entenda agora como funcionam esses luminosos: são semelhantes às lâmpadas fluorescentes, onde os elétrons presentes são excitados até que retornem à órbita original. Essa órbita energizada emite luz, que só é transmitida enquanto há fornecimento de energia. Se o abastecimento for interrompido, ou seja, quando os elétrons retornam à estabilidade, cessa a emissão de energia.
A quimioluminescência consiste na emissão de luz gerada por uma reação química, é a que encontramos nas “pulseirinhas de gás Neon”, que podem emitir várias cores, dependendo da pressão do gás e de sua composição. Observe a composição do gás e suas cores respectivas: Neônio (Ne) + Gás carbônico (CO2) → luz violeta Neônio (Ne) + Mercúrio (Hg) → luz azul Neônio (Ne) puro → luz vermelha
A bioluminescência ocorre em organismos vivos, ela é encontrada principalmente no fundo do oceano, mas vaga-lumes também possuem esta habilidade.
Você já usou pulseiras de Neon? Nas festas de casamento, formaturas, festas em geral, elas se tornaram a sensação do momento, encantando as pessoas pela luz que emitem em meio à penumbra das boates. Essas luzes equivalem à fluorescência do gás Neon (Ne, décimo elemento da tabela periódica, do grupo dos gases nobres) mediante a passagem de uma corrente elétrica.
O Neon é obtido do ar atmosférico pelo processo da liquefação fracionada e é muito utilizado comercialmente. O processo de obtenção consiste no resfriamento do ar até que esse fique liquefeito gradativamente e preparado para aquecer. Os chamados luminosos de Neon são muito usados na publicidade: iluminação de anúncios comerciais, em letreiros luminosos com o intuito de chamar a atenção do público, basta olhar para a cidade à noite que veremos luzes de Neon.
Entenda agora como funcionam esses luminosos: são semelhantes às lâmpadas fluorescentes, onde os elétrons presentes são excitados até que retornem à órbita original. Essa órbita energizada emite luz, que só é transmitida enquanto há fornecimento de energia. Se o abastecimento for interrompido, ou seja, quando os elétrons retornam à estabilidade, cessa a emissão de energia.
A quimioluminescência consiste na emissão de luz gerada por uma reação química, é a que encontramos nas “pulseirinhas de gás Neon”, que podem emitir várias cores, dependendo da pressão do gás e de sua composição. Observe a composição do gás e suas cores respectivas: Neônio (Ne) + Gás carbônico (CO2) → luz violeta Neônio (Ne) + Mercúrio (Hg) → luz azul Neônio (Ne) puro → luz vermelha
A bioluminescência ocorre em organismos vivos, ela é encontrada principalmente no fundo do oceano, mas vaga-lumes também possuem esta habilidade.
Formigas gostam de adoçante?
Formiga gosta de adoçante artificial? Esta é uma pergunta bem curiosa, considerando que esta espécie adora o nosso tradicional açúcar.
A diferença fundamental está na composição. A sacarose sólida que consumimos na forma de açúcar é rica em carboidratos, um dos alimentos preferidos das formigas. E não é para menos, as calorias provenientes do consumo de sacarose fornecem a energia necessária para a sobrevivência da espécie.
A quantidade razoavelmente pequena de açúcar que as formigas consomem já é suficiente para as manterem em movimento, uma vez que cada grama de sacarose fornece 4 Kcal para as pequeninas.
Enquanto isso nos conformamos com o sabor artificial dos adoçantes, até mesmo por que possuem uma capacidade maior de adoçar (300 vezes mais do que açúcar). É válido ressaltar que, em vez da sacarose, os adoçantes contêm sacarina, substância que não é metabolizada pelo organismo. Daí o porquê das formigas não se interessarem por ela, a sacarina não produz nenhuma energia.
Gelo Seco
O dióxido de carbono sólido “CO2 (s)” é conhecido como gelo seco e é muito usado como efeito especial ou recurso cênico em filmes de terror e shows de rock. Ele é resfriado a uma temperatura inferior a -78ºC, e ao entrar em contato com a pressão atmosférica é aquecido e torna-se um gás de dióxido de carbono.
Esse processo é conhecido por Sublimação e consiste na passagem de um sólido ao estado de vapor sem antes passar pelo estado líquido, ou seja, à medida que o gelo-seco é aquecido, ele se transforma diretamente em dióxido de carbono gasoso e não em líquido.
Quando o ar quente (ou água) passa sobre o gelo-seco, forma-se uma densa nuvem branca, que permanece ao nível do chão, produzindo o efeito especial usado no cinema. Mas não é só para esse fim que o dióxido de carbono sólido é usado, a temperatura extremamente gelada e a característica da sublimação fazem do gelo-seco uma excelente opção para refrigeração. Por exemplo, se você precisar fazer uma longa viagem com um produto congelado, você pode revesti-lo com gelo-seco. O produto estará congelado quando chegar ao destino e com a vantagem de que nada estará molhado, diferentemente do que aconteceria se fosse usado gelo normal.
Mas como é produzido o dióxido de carbono congelado? Para se fazer gelo-seco é preciso começar com um recipiente de alta pressão cheio de dióxido de carbono líquido. Quando se libera o dióxido de carbono líquido do tanque, a expansão do líquido e a alta velocidade de evaporação do dióxido de carbono gasoso esfriam o restante do líquido ao ponto de congelamento, no qual ele se transforma diretamente em sólido.
Você alguma vez já viu um extintor de incêndio de dióxido de carbono em ação? É formada no bocal uma espécie de "neve", esse tipo de extintor contém dióxido de carbono líquido em alta pressão.
Esse processo é conhecido por Sublimação e consiste na passagem de um sólido ao estado de vapor sem antes passar pelo estado líquido, ou seja, à medida que o gelo-seco é aquecido, ele se transforma diretamente em dióxido de carbono gasoso e não em líquido.
Quando o ar quente (ou água) passa sobre o gelo-seco, forma-se uma densa nuvem branca, que permanece ao nível do chão, produzindo o efeito especial usado no cinema. Mas não é só para esse fim que o dióxido de carbono sólido é usado, a temperatura extremamente gelada e a característica da sublimação fazem do gelo-seco uma excelente opção para refrigeração. Por exemplo, se você precisar fazer uma longa viagem com um produto congelado, você pode revesti-lo com gelo-seco. O produto estará congelado quando chegar ao destino e com a vantagem de que nada estará molhado, diferentemente do que aconteceria se fosse usado gelo normal.
Mas como é produzido o dióxido de carbono congelado? Para se fazer gelo-seco é preciso começar com um recipiente de alta pressão cheio de dióxido de carbono líquido. Quando se libera o dióxido de carbono líquido do tanque, a expansão do líquido e a alta velocidade de evaporação do dióxido de carbono gasoso esfriam o restante do líquido ao ponto de congelamento, no qual ele se transforma diretamente em sólido.
Você alguma vez já viu um extintor de incêndio de dióxido de carbono em ação? É formada no bocal uma espécie de "neve", esse tipo de extintor contém dióxido de carbono líquido em alta pressão.
Histórico Químico das Anestesias
Acompanhe o processo de evolução da anestesia, a responsável pela revolução na medicina:
5000 a.C. ao século XI d.C: nesta época os métodos eram bem naturais, os egípcios usavam plantas que causavam o efeito sedativo, já os chineses utilizavam a acupuntura para anestesiar os pacientes (este método utiliza de agulhas anexadas ao corpo para obter um relaxamento).
Século XVI ao século XVIII: o álcool era empregado em pacientes que iriam se submeter a pequenas cirurgias, como as extrações dentárias. A ingestão do álcool não era muito eficiente, e o paciente acabava sentindo alguma dor.
1773: neste ano foi descoberta a existência do gás dióxido de nitrogênio, este gás possuía a propriedade de deixar o paciente inconsciente, era aplicado por inalação.
1846: foi o ano em que aconteceu a primeira cirurgia com anestesia geral, em razão da repercussão, foi realizada em público nos Estados Unidos. Uma substância capaz de tirar uma pessoa de seu estado normal, levando-a a desmaiar e permitir assim o trabalho dos médicos, qual seria ela? O éter, que ao ser inalado provoca um desvio dos sentidos, o paciente ficava desacordado.
1930-1970: chegou a vez das anestesias injetáveis, elas eram mais seguras e neste mesmo período surgiram as salas de recuperação pós-operatório, ou seja, houve um grande avanço no que diz respeito às cirurgias. A primeira anestesia por via sanguínea foi o ciclopropano.
1980-2008: nesta época a tecnologia permitiu inserir computadores nas salas de cirurgia, eles ficaram responsáveis pela monitoração do paciente. Este foi um importante passo na história da Anestesia, graças aos modernos aparelhos é possível registrar as funções vitais e administrar até mesmo os medicamentos aplicados.Mas como as modernas anestesias fazem o paciente dormir profundamente?
Os anestésicos caem na corrente sanguínea e vão diretamente para o cérebro, lá estão presentes as substâncias que se ligam aos neurônios para manter o corpo acordado, e é justamente sobre esta ação que as anestesias influem. Os anestésicos bloqueiam a ação destas substâncias presentes no cérebro levando a um relaxamento do corpo e a total perca da consciência.
5000 a.C. ao século XI d.C: nesta época os métodos eram bem naturais, os egípcios usavam plantas que causavam o efeito sedativo, já os chineses utilizavam a acupuntura para anestesiar os pacientes (este método utiliza de agulhas anexadas ao corpo para obter um relaxamento).
Século XVI ao século XVIII: o álcool era empregado em pacientes que iriam se submeter a pequenas cirurgias, como as extrações dentárias. A ingestão do álcool não era muito eficiente, e o paciente acabava sentindo alguma dor.
1773: neste ano foi descoberta a existência do gás dióxido de nitrogênio, este gás possuía a propriedade de deixar o paciente inconsciente, era aplicado por inalação.
1846: foi o ano em que aconteceu a primeira cirurgia com anestesia geral, em razão da repercussão, foi realizada em público nos Estados Unidos. Uma substância capaz de tirar uma pessoa de seu estado normal, levando-a a desmaiar e permitir assim o trabalho dos médicos, qual seria ela? O éter, que ao ser inalado provoca um desvio dos sentidos, o paciente ficava desacordado.
1930-1970: chegou a vez das anestesias injetáveis, elas eram mais seguras e neste mesmo período surgiram as salas de recuperação pós-operatório, ou seja, houve um grande avanço no que diz respeito às cirurgias. A primeira anestesia por via sanguínea foi o ciclopropano.
1980-2008: nesta época a tecnologia permitiu inserir computadores nas salas de cirurgia, eles ficaram responsáveis pela monitoração do paciente. Este foi um importante passo na história da Anestesia, graças aos modernos aparelhos é possível registrar as funções vitais e administrar até mesmo os medicamentos aplicados.Mas como as modernas anestesias fazem o paciente dormir profundamente?
Os anestésicos caem na corrente sanguínea e vão diretamente para o cérebro, lá estão presentes as substâncias que se ligam aos neurônios para manter o corpo acordado, e é justamente sobre esta ação que as anestesias influem. Os anestésicos bloqueiam a ação destas substâncias presentes no cérebro levando a um relaxamento do corpo e a total perca da consciência.
Hipoclorito de Sódio
O composto químico Hipoclorito de sódio, de fórmula NaClO, é usado como desinfetante e como agente alvejante. NaClO recebe o nome popular de água sanitária e é produzido pela reação de cloro com hidróxido de sódio, vejamos o processo:
O cloro é borbulhado em um recipiente e, ao mesmo tempo, introduz-se vagarosamente uma solução alcalina de hidróxido de sódio (soda cáustica). A reação entre os componentes dessa mistura dá origem ao hipoclorito.
O hipoclorito é um forte agente oxidante, usado em ambientes domésticos para eliminar vírus e bactérias, uma vez que estes são extremamente sensíveis à oxidação. Alvejantes se tornam eficientes para esterilizar a superfície das cozinhas, roupa suja, pias e banheiros.
Um alerta sobre o NaClO: ambientalistas reprovam seu uso porque reagem quimicamente com outras espécies presentes na água. Por exemplo, quando eliminamos NaClO pela rede de esgoto, estamos enviando-o para os rios, lá ele se mistura com outros compostos e dá origem a substâncias carcinogênicas.
Luminol
A cada dia que passa está mais difícil para um criminoso esconder vestígios da polícia, pode ser o fim dos homicídios sem solução. Mesmo que o assassino lave cuidadosamente o local do crime ou que tenha se passado até seis anos, é possível identificar os mínimos vestígios de sangue em praticamente qualquer tipo de superfície, mesmo as lisas como os azulejos.
O responsável por esse avanço é o Luminol, que é um produto químico especial capaz de fazer aparecer traços de sangue até então invisíveis a olho nu, se tornando um grande aliado dos investigadores para revelar cenas ocultas de um crime.
O processo começa pelo reconhecimento do local onde se passou o crime, o Luminol então é aplicado com borrifadores especiais nas possíveis áreas onde pode haver resquícios sanguíneos. A reação acontece quando as moléculas do Luminol entram em contato com o sangue. As partículas de ferro existentes na hemoglobina (uma proteína do sangue) se acendem gerando uma intensa luz azul que pode ser vista em um local escuro ou no momento em que se apaga a luz do ambiente.
Assim que a substância se mistura à hemoglobina, bastam apenas 5 (cinco) segundos para a luz radiante se tornar visível. A sua utilização é muito importante, pois a partir das manchas de sangue pode-se sugerir uma dinâmica do que teria acontecido e assim solucionar o crime.
Com a ajuda do Luminol, os pesquisadores conseguem detectar até traços de DNA que permitem o reconhecimento da vítima e do culpado. O processo químico responsável por essa façanha é chamado de quimiluminescência, fenômeno similar ao que faz vaga-lumes e bastões luminosos brilharem.
Segundo os pesquisadores responsáveis pela elaboração do Luminol, é praticamente impossível alguém limpar o sangue de uma forma que o Luminol não consiga identificá-lo. Por exemplo, em uma pia completamente branca que seja lavada várias vezes com fortes produtos de limpeza (água sanitária), mesmo assim a substância encontrará indícios quando tiver sangue.
O responsável por esse avanço é o Luminol, que é um produto químico especial capaz de fazer aparecer traços de sangue até então invisíveis a olho nu, se tornando um grande aliado dos investigadores para revelar cenas ocultas de um crime.
O processo começa pelo reconhecimento do local onde se passou o crime, o Luminol então é aplicado com borrifadores especiais nas possíveis áreas onde pode haver resquícios sanguíneos. A reação acontece quando as moléculas do Luminol entram em contato com o sangue. As partículas de ferro existentes na hemoglobina (uma proteína do sangue) se acendem gerando uma intensa luz azul que pode ser vista em um local escuro ou no momento em que se apaga a luz do ambiente.
Assim que a substância se mistura à hemoglobina, bastam apenas 5 (cinco) segundos para a luz radiante se tornar visível. A sua utilização é muito importante, pois a partir das manchas de sangue pode-se sugerir uma dinâmica do que teria acontecido e assim solucionar o crime.
Com a ajuda do Luminol, os pesquisadores conseguem detectar até traços de DNA que permitem o reconhecimento da vítima e do culpado. O processo químico responsável por essa façanha é chamado de quimiluminescência, fenômeno similar ao que faz vaga-lumes e bastões luminosos brilharem.
Segundo os pesquisadores responsáveis pela elaboração do Luminol, é praticamente impossível alguém limpar o sangue de uma forma que o Luminol não consiga identificá-lo. Por exemplo, em uma pia completamente branca que seja lavada várias vezes com fortes produtos de limpeza (água sanitária), mesmo assim a substância encontrará indícios quando tiver sangue.
Manteiga dentro ou fora da geladeira?
Qual é o melhor local para armazenar a manteiga? Se você é daqueles que deixa este derivado do leite fora da geladeira só para facilitar na hora de passá-lo no pão não sabe o risco que está correndo.
Este ingrediente fundamental do café da manhã é um dos que apresenta maiores riscos de perecer. Seu ingrediente principal, o creme de leite, é rico em gorduras passíveis de sofrerem oxidação. A porcentagem de gordura láctea na manteiga é de 82 %.
Como se vê, a manteiga é composta basicamente por gorduras, e se deixada em ambientes inadequados (exposta ao calor) certamente sofrerá deterioração. Se você ingerir este produto com qualidade comprometida poderá passar por uma desagradável intoxicação alimentar.
É fácil perceber se a manteiga está estragada, o gosto amargo e rançoso é característico de gorduras oxidadas.
Por que a geladeira é a melhor opção para guardar a manteiga? A temperatura nos refrigeradores gira em torna de 0 a 5 °C, neste ambiente as bactérias não se proliferam e o produto tem sua vida útil prolongada.
Tudo bem que na geladeira a manteiga se conserva por mais tempo, mas quando resfriada ela adquire um aspecto bem durinho, eis o problema! Se você deseja obter a manteiga em uma consistência mais pastosa (o que facilita bastante na hora de passá-la no pão) é só retirá-la minutos antes do consumo. Mas lembre-se, este período não pode exceder duas horas.
Dica: se você não quer acordar de madrugada para retirar a manteiga para o café da manhã às 08, deixe-a na porta da geladeira, onde a temperatura é mais amena (menos fria).
Este ingrediente fundamental do café da manhã é um dos que apresenta maiores riscos de perecer. Seu ingrediente principal, o creme de leite, é rico em gorduras passíveis de sofrerem oxidação. A porcentagem de gordura láctea na manteiga é de 82 %.
Como se vê, a manteiga é composta basicamente por gorduras, e se deixada em ambientes inadequados (exposta ao calor) certamente sofrerá deterioração. Se você ingerir este produto com qualidade comprometida poderá passar por uma desagradável intoxicação alimentar.
É fácil perceber se a manteiga está estragada, o gosto amargo e rançoso é característico de gorduras oxidadas.
Por que a geladeira é a melhor opção para guardar a manteiga? A temperatura nos refrigeradores gira em torna de 0 a 5 °C, neste ambiente as bactérias não se proliferam e o produto tem sua vida útil prolongada.
Tudo bem que na geladeira a manteiga se conserva por mais tempo, mas quando resfriada ela adquire um aspecto bem durinho, eis o problema! Se você deseja obter a manteiga em uma consistência mais pastosa (o que facilita bastante na hora de passá-la no pão) é só retirá-la minutos antes do consumo. Mas lembre-se, este período não pode exceder duas horas.
Dica: se você não quer acordar de madrugada para retirar a manteiga para o café da manhã às 08, deixe-a na porta da geladeira, onde a temperatura é mais amena (menos fria).
Vodka e Mendeleev
A vodka foi descoberta por volta do ano de 1893 na Rússia, com o nome de “aguinha” (vodka em Russo). O responsável pela façanha foi nada menos que o renomado cientista Dmitri Ivanovich Mendeleev. Na época, professor da Universidade de São Petersburgo, pesquisou a fórmula mais apropriada para a bebida.
Para chegar à fórmula ideal, Mendeleev dedicou-se durante um ano à tarefa de misturar criteriosamente água e álcool em diferentes proporções. Mendeleev chegou à composição perfeita para a vodka: 40% de álcool e 60% de água. A chamada Vodka Russa tem registrada por lei, a fórmula proposta pelo cientista.
O professor Mendeleev tornou-se figura ilustríssima na Rússia, tanto que é visto como o grande químico, autor da bebida no Museu da Vodka, em Moscou. Entre as façanhas de Mendeleev encontra-se um importante trabalho: a organização da Tabela Periódica, pois ele foi o cientista que, em meio a tentativas de descobrir uma forma de organizar os elementos, chegou a uma tabela, e é nela que se baseia a atual.
É válido lembrar que Mendeleev foi também responsável pela organização da Tabela Periódica. Ele relacionou a massa atômica às propriedades dos elementos, e em 1869, surgiu a 1ª Tabela Periódica dos Elementos.
Para chegar à fórmula ideal, Mendeleev dedicou-se durante um ano à tarefa de misturar criteriosamente água e álcool em diferentes proporções. Mendeleev chegou à composição perfeita para a vodka: 40% de álcool e 60% de água. A chamada Vodka Russa tem registrada por lei, a fórmula proposta pelo cientista.
O professor Mendeleev tornou-se figura ilustríssima na Rússia, tanto que é visto como o grande químico, autor da bebida no Museu da Vodka, em Moscou. Entre as façanhas de Mendeleev encontra-se um importante trabalho: a organização da Tabela Periódica, pois ele foi o cientista que, em meio a tentativas de descobrir uma forma de organizar os elementos, chegou a uma tabela, e é nela que se baseia a atual.
É válido lembrar que Mendeleev foi também responsável pela organização da Tabela Periódica. Ele relacionou a massa atômica às propriedades dos elementos, e em 1869, surgiu a 1ª Tabela Periódica dos Elementos.
O pH da boca e a deterioração dos dentes
Para mastigarmos um alimento precisamos de estruturas essenciais: os dentes. Eles fazem parte da nossa sobrevivência, a nutrição do nosso corpo depende desse fator, é preciso então tomar os devidos cuidados para conservá-los.
Essa preocupação com a higiene bucal não surgiu recentemente, desde a Antigüidade (2000 a.C) já se tem relatos dos egípcios fazendo o uso da mistura abrasiva de pedra-pomes pulverizada e vinagre para a limpeza dos dentes. Mas, o que é pedra-pomes?
A pedra-pomes é uma mistura de óxidos formada por 70% de Óxido de Silício (SiO2) e 30% de Óxido de Alumínio (Al2O3).
Essa preocupação com a higiene bucal não surgiu recentemente, desde a Antigüidade (2000 a.C) já se tem relatos dos egípcios fazendo o uso da mistura abrasiva de pedra-pomes pulverizada e vinagre para a limpeza dos dentes. Mas, o que é pedra-pomes?
A pedra-pomes é uma mistura de óxidos formada por 70% de Óxido de Silício (SiO2) e 30% de Óxido de Alumínio (Al2O3).
Em se tratando da composição dos dentes, o mineral hidroxiapatita é o principal constituinte, cuja fórmula é Ca5(PO4)3OH. A hidroxiapatita é parcialmente solúvel em soluções ácidas, o que pode levar à deterioração dos dentes.
O carboidrato-proteína chamado Mucina forma uma película sobre os dentes: o Biofilme (placa). O importante é que esta placa seja removida pela escovação, porque ela retém as partículas de alimentos causando a deterioração dos dentes.
As bactérias existentes em nossa saliva fermentam os carboidratos que ingerimos, e produz o ácido lático. Sendo assim, o pH da boca fica abaixo de 4,5 (ácido). A reação do ácido com a Hidroxiapatita forma um sal que é solúvel em H2O, por isso parte da Hidroxiapatita e se dissolve, o que favorecerá o aparecimento de pequenas cavidades nos dentes.
As bactérias existentes em nossa saliva fermentam os carboidratos que ingerimos, e produz o ácido lático. Sendo assim, o pH da boca fica abaixo de 4,5 (ácido). A reação do ácido com a Hidroxiapatita forma um sal que é solúvel em H2O, por isso parte da Hidroxiapatita e se dissolve, o que favorecerá o aparecimento de pequenas cavidades nos dentes.
Existem fatores que agravam ainda mais o problema, como a doença bulimia (um distúrbio provocado pela ingestão de grande quantidade de alimentos seguida de vômito), que faz com que o ácido clorídrico existente no estômago eliminado junto com o vômito, reduza ainda mais o pH, chegando a 1,5 (muito ácido).
Outro agravante para a saúde bucal é o hábito de fumar. O cigarro pode causar desde manchas nos dentes até câncer labial, além disso, a nicotina influencia na pigmentação, deixando o sorriso amarelado.
Mas existem alternativas que ajudam a combater a corrosão dentária, como aplicação periódica de flúor. Os íons fluoreto (F-) presentes no flúor transformam a Hidroxiapatita em fluorapatita que protege ainda mais os dentes, por ser menos solúvel em ácidos.
Outro agravante para a saúde bucal é o hábito de fumar. O cigarro pode causar desde manchas nos dentes até câncer labial, além disso, a nicotina influencia na pigmentação, deixando o sorriso amarelado.
Mas existem alternativas que ajudam a combater a corrosão dentária, como aplicação periódica de flúor. Os íons fluoreto (F-) presentes no flúor transformam a Hidroxiapatita em fluorapatita que protege ainda mais os dentes, por ser menos solúvel em ácidos.
O pH do xampu e a química do cabelo
Os xampus que andam mexendo com a cabeça da mulherada são os xampus com pH neutro. Essa onda garante beleza e proteção às madeixas, além de conservar melhor os modernos tratamentos, tudo porque esse xampu possui a propriedade de não agredir os cabelos, será verdade? Existe uma explicação científica para esse fato?
Antes de explicar como os xampus auxiliam nos tratamentos capilares, vejamos em que consiste a estrutura dos cabelos. Um fio de cabelo contém moléculas que se ligam de maneiras diferentes, a estrutura do cabelo muda conforme a ligação.
São basicamente três formas de ligações moleculares presentes nos cabelos: pontes salinas, ligações de hidrogênio e pontes de dissulfeto. O segredo dos xampus está justamente aqui: mudar as interações que formam o fio de cabelo.
Para exemplificar, vejamos como mudar o visual apenas molhando o cabelo. Você já observou que os cabelos molhados tendem a permanecer sem volume? As pessoas com cabelos rebeldes usam dessa propriedade para compor um visual mais agradável, mas o problema é que quando secos, os cabelos voltam à posição inicial.
A explicação científica para este fato é que quando os fios de cabelo são molhados as ligações de hidrogênio presentes se quebram, mas ao secarem estas ligações são novamente formadas. Foi baseada nesta teoria que surgiram os xampus com pH neutro.
Quando o cabelo é lavado com xampu ácido (pH ≈ 1,5), além das ligações de hidrogênio, são quebradas também as pontes salinas, o resultado é o cabelo rebelde e seco. E não adianta procurar um xampu com pH elevado (pH ≥ 8), estes são os piores, pois são responsáveis pelo aparecimento das famosas pontas duplas, em razão das quebras das pontes de dissulfeto presentes nas extremidades dos cabelos.
Então, qual é o xampu ideal para manter os cabelos fortes e saudáveis? O recomendável é usar xampus com pH entre 4,0 e 5,0 (pH moderado). Com base nestas informações é possível formular um xampu ideal para seus cabelos, além de aprender mais sobre pH ainda ganhará um visual novo.
Antes de explicar como os xampus auxiliam nos tratamentos capilares, vejamos em que consiste a estrutura dos cabelos. Um fio de cabelo contém moléculas que se ligam de maneiras diferentes, a estrutura do cabelo muda conforme a ligação.
São basicamente três formas de ligações moleculares presentes nos cabelos: pontes salinas, ligações de hidrogênio e pontes de dissulfeto. O segredo dos xampus está justamente aqui: mudar as interações que formam o fio de cabelo.
Para exemplificar, vejamos como mudar o visual apenas molhando o cabelo. Você já observou que os cabelos molhados tendem a permanecer sem volume? As pessoas com cabelos rebeldes usam dessa propriedade para compor um visual mais agradável, mas o problema é que quando secos, os cabelos voltam à posição inicial.
A explicação científica para este fato é que quando os fios de cabelo são molhados as ligações de hidrogênio presentes se quebram, mas ao secarem estas ligações são novamente formadas. Foi baseada nesta teoria que surgiram os xampus com pH neutro.
Quando o cabelo é lavado com xampu ácido (pH ≈ 1,5), além das ligações de hidrogênio, são quebradas também as pontes salinas, o resultado é o cabelo rebelde e seco. E não adianta procurar um xampu com pH elevado (pH ≥ 8), estes são os piores, pois são responsáveis pelo aparecimento das famosas pontas duplas, em razão das quebras das pontes de dissulfeto presentes nas extremidades dos cabelos.
Então, qual é o xampu ideal para manter os cabelos fortes e saudáveis? O recomendável é usar xampus com pH entre 4,0 e 5,0 (pH moderado). Com base nestas informações é possível formular um xampu ideal para seus cabelos, além de aprender mais sobre pH ainda ganhará um visual novo.
O porquê da cor da urina
A urina é a prova de que nossos rins estão funcionando corretamente, é resultado do trabalho de purificação do sangue. Ela possui várias características como, por exemplo, sabor salgado e cor amarela. A primeira delas se explica pelo fato de a urina reter o sal da corrente sanguínea, e a segunda tem sua origem na incrível função do organismo de se livrar de substâncias nocivas à nossa saúde.
A cor amarela de seu “xixi”, assim como a urina é popularmente chamada, tem origem em seus componentes. A amônia (proveniente das células) e a bilirrubina (originada no romper da hemoglobina) são substâncias indesejáveis em nosso corpo, daí mais uma tarefa para nossos filtros, os rins, que se encarregam de converter a amônia em ureia e a bilirrubina em urobilinogênios. Esses últimos dão a cor amarela à nossa urina.
A água que ingerimos tem o poder de diluir os urobilinogênios, tornando a urina mais clarinha, mas se ela está apresentando uma cor forte (amarelo escuro), é bem provável que você esteja ingerindo pouco líquido. Trate de tomar mais água e se o problema não for resolvido, procure um médico.
TNT- Trinitrotolueno
A sigla TNT significa trinitrotolueno. Ele é um nitrocomposto e seu nome químico é 2-metil-1,3,5-trinitrobenzeno. Sua fórmula está representada abaixo:
.jpg)
Ele é um sólido amarelo cristalino que possui um alto potencial explosivo. O TNT é tão explosivo que detona com apenas uma temperatura de 80°C ou uma fagulha elétrica. Isto se deve porque na sua estrutura existem átomos de oxigênio suficientes para que ocorra a combustão.
O método de obtenção do trinitrotolueno é a nitração total do tolueno, ou seja, quando o tolueno reage com o ácido nítrico (HNO3). Esta nitração total significa que serão feitas nitrações até que todas as substituições possíveis sejam feitas. No caso do tolueno é possível no máximo três substituições no núcleo do anel benzênico: duas em orto e uma em para. Vejamos esta reação de substituição abaixo:
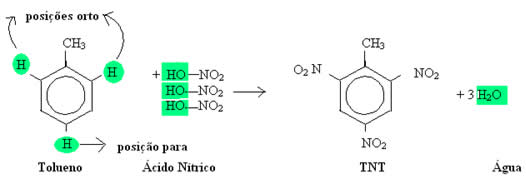
O TNT, assim como os explosivos tretil (N-metil-2,4,6-trinitrofenil-nitramina) e RDX (Ciclotrimetilenotrinitro-amina), foi inventado no início do século XX, principalmente em função da Primeira Guerra Mundial.
Apesar de ser muitas vezes utilizado como uma arma, o seu uso pacífico também é muito extenso. Os explosivos plásticos, por exemplo, muitas vezes usados em implosões de prédios e outras edificações, são na realidade o próprio TNT interligado a um dispositivo. Este dispositivo emite uma fagulha elétrica ao ser acionado, o que causa a explosão do TNT.
Sexo seguro com poliuretano
A camisinha, um dos métodos contraceptivos mais seguros e que oferece proteção contra todas as doenças sexualmente transmissíveis, é composta de polímeros. A cada dia a ciência evolui e inova os produtos e o método contraceptivo mais popular não poderia ficar de fora.
O poliuretano é o polímero desenvolvido para compor preservativos mais resistentes que os de látex. E mais, o material é super leve, o que permite que sejam mais finos e confortáveis.
E por que esse polímero consegue ser tão leve? Para entender é preciso saber como os químicos preparam esse material. O polímero é um produto da reação de moléculas que tem um grupo álcool com outras que tem grupos isocianato. À medida que a molécula se mistura, uma forte ligação química se forma, e a adição de líquido volátil faz com que bolhas de gás se formem no plástico. Daí o porquê da constituição do poliuretano ser 95% de gás, o que o torna altamente leve.
Só para demonstrar quão versátil é o poliuretano, conheça suas outras aplicações: nos carros, é usado como enchimento de assentos, revestimento à prova de som embaixo dos carpetes, painéis isolantes, etc. Apesar de ser usado em muitos dos acessórios do automóvel, o material garante conforto e leveza ao veículo, o que resulta em economia de combustível.
O poliuretano é o polímero desenvolvido para compor preservativos mais resistentes que os de látex. E mais, o material é super leve, o que permite que sejam mais finos e confortáveis.
E por que esse polímero consegue ser tão leve? Para entender é preciso saber como os químicos preparam esse material. O polímero é um produto da reação de moléculas que tem um grupo álcool com outras que tem grupos isocianato. À medida que a molécula se mistura, uma forte ligação química se forma, e a adição de líquido volátil faz com que bolhas de gás se formem no plástico. Daí o porquê da constituição do poliuretano ser 95% de gás, o que o torna altamente leve.
Só para demonstrar quão versátil é o poliuretano, conheça suas outras aplicações: nos carros, é usado como enchimento de assentos, revestimento à prova de som embaixo dos carpetes, painéis isolantes, etc. Apesar de ser usado em muitos dos acessórios do automóvel, o material garante conforto e leveza ao veículo, o que resulta em economia de combustível.
Sangue de Cinema
Quem nunca ficou atemorizado em ver tanto sangue em filmes de terror? Alguma vez já se perguntou a composição deste efeito especial? A resposta é simples, vem do laboratório. Quem diria, o líquido vermelho devorado por vampiros em filmes fictícios, não passa de um composto artificial produzido em laboratório a partir de polímeros.
Os produtos mais usados para se fazer sangue falso são: C.M.C (Carboximetilcelulose de sódio ou Metilcelulose ou Metacelulose), Glucose (açúcar extraído do milho) e corante líquido. C.M.C é um polímero hidrossolúvel derivado de celulose para uso alimentar. Aliás, todos os ingredientes citados são usados por confeiteiros na confecção de bolos. E aqui encontramos uma aplicação bem curiosa, afinal, se não houvesse este artifício, como os filmes de suspense ficariam tão emocionantes?
Os sangues artificiais desempenham diferentes papéis na telinha, alguns são usados para dar efeitos de ferimento instantâneo, outros para feridas em recuperação, e até para olhos e boca.
Abaixo uma lista dos tipos artificiais de sangue e suas aplicações mais apropriadas:
Sangue em gel: com certeza este passa o efeito mais impactante, é usado para representar sangue fresco, daqueles ferimentos que ocorrem no ato da cena.
Sangue seco: usado para transmitir a ideia de seco, ideal para perna amputada e ferimentos velhos. Possui coloração mais escura e é mais consistente que o sangue em gel.
Os produtos mais usados para se fazer sangue falso são: C.M.C (Carboximetilcelulose de sódio ou Metilcelulose ou Metacelulose), Glucose (açúcar extraído do milho) e corante líquido. C.M.C é um polímero hidrossolúvel derivado de celulose para uso alimentar. Aliás, todos os ingredientes citados são usados por confeiteiros na confecção de bolos. E aqui encontramos uma aplicação bem curiosa, afinal, se não houvesse este artifício, como os filmes de suspense ficariam tão emocionantes?
Os sangues artificiais desempenham diferentes papéis na telinha, alguns são usados para dar efeitos de ferimento instantâneo, outros para feridas em recuperação, e até para olhos e boca.
Abaixo uma lista dos tipos artificiais de sangue e suas aplicações mais apropriadas:
Sangue em gel: com certeza este passa o efeito mais impactante, é usado para representar sangue fresco, daqueles ferimentos que ocorrem no ato da cena.
Sangue seco: usado para transmitir a ideia de seco, ideal para perna amputada e ferimentos velhos. Possui coloração mais escura e é mais consistente que o sangue em gel.
Sangue para olhos: lágrimas de sangue que deixam os olhos do ator avermelhados, com efeito dramático.
Sangue em cápsulas: efeito especial para cenas de pessoas baleadas, onde o sangue sai pela boca. Basta o ator morder a cápsula e o sangue é expulso, lembrando que o material não é tóxico e pode ser ingerindo. Essas características o tornam ideal para uso em filmes de Vampiros.
Sangue em cápsulas: efeito especial para cenas de pessoas baleadas, onde o sangue sai pela boca. Basta o ator morder a cápsula e o sangue é expulso, lembrando que o material não é tóxico e pode ser ingerindo. Essas características o tornam ideal para uso em filmes de Vampiros.
O que tem no meu chiclete?
Se você é fã das gomas de mascar, principalmente daquelas que ficam horas na boca sem perder propriedades como: maciez, textura característica, sabor prolongado, etc. Saiba agora quais os ingredientes conferem todas estas particularidades dos populares chicletes sem açúcar:
Maciez: já reparou que quando retiramos o chiclete da embalagem, o mesmo possui uma forma mais rígida que lhe confere o formato? Mas basta o colocarmos na boca e já percebemos a mudança na textura: o chiclete fica macio quando o mastigamos, sabe por quê? A “glicerina” presente na composição faz com que o chiclete amoleça ao ser mascado, a temperatura do interior da boca ativa esta função.
Elasticidade: esta característica torna o chiclete único: poder mascar, fazer bolhas, brincar com o alimento, pode ser um passatempo relaxante. Surge a pergunta: qual componente é responsável por esta particularidade? A chamada “Goma base” é o componente principal, é produzida a partir de derivados do petróleo, este talvez seja o maior atrativo do chiclete: a massa sintética que estica e puxa.
Sabor adocicado: o fato de não conterem açúcar não significa que não sejam doces, esta característica é proporcionada pelo “Manitol”, um adoçante natural encontrado também na beterraba.
Mas as vantagens não param por aí, alguns desses chicletes ainda retiram manchas dentárias. Isso é possível graças ao Estearato de sódio, um esfoliante capaz de remover impurezas

Estearato de sódio: sal esfoliante também presente em sabonetes.
Aliás, a ausência de açúcar na composição ao lado da capacidade de retirar manchas, convenceu a Associação Brasileira de Odontologia (ABO) a aprovar esta guloseima como não prejudicial aos dentes. Daí o porquê da popularidade, além de possuir delicioso sabor e não ser calórico, ainda promove sua saúde bucal.
Maciez: já reparou que quando retiramos o chiclete da embalagem, o mesmo possui uma forma mais rígida que lhe confere o formato? Mas basta o colocarmos na boca e já percebemos a mudança na textura: o chiclete fica macio quando o mastigamos, sabe por quê? A “glicerina” presente na composição faz com que o chiclete amoleça ao ser mascado, a temperatura do interior da boca ativa esta função.
Elasticidade: esta característica torna o chiclete único: poder mascar, fazer bolhas, brincar com o alimento, pode ser um passatempo relaxante. Surge a pergunta: qual componente é responsável por esta particularidade? A chamada “Goma base” é o componente principal, é produzida a partir de derivados do petróleo, este talvez seja o maior atrativo do chiclete: a massa sintética que estica e puxa.
Sabor adocicado: o fato de não conterem açúcar não significa que não sejam doces, esta característica é proporcionada pelo “Manitol”, um adoçante natural encontrado também na beterraba.
Mas as vantagens não param por aí, alguns desses chicletes ainda retiram manchas dentárias. Isso é possível graças ao Estearato de sódio, um esfoliante capaz de remover impurezas

Estearato de sódio: sal esfoliante também presente em sabonetes.
Aliás, a ausência de açúcar na composição ao lado da capacidade de retirar manchas, convenceu a Associação Brasileira de Odontologia (ABO) a aprovar esta guloseima como não prejudicial aos dentes. Daí o porquê da popularidade, além de possuir delicioso sabor e não ser calórico, ainda promove sua saúde bucal.
O que faz com que a cola cole?
Quando precisamos colar algo surge aquela dúvida: qual o melhor tipo de cola? Ao contrário do que muita gente pensa, existe um tipo de cola para cada material específico. O princípio fundamental é a afinidade da cola, ela precisa combinar com a superfície que for colar. Por exemplo, uma cola de tecido não serve para colar materiais plásticos, e vice-versa. É com base nesse princípio que existe uma variedade de colas disponíveis no mercado: cola de sapateiro, cola branca (PVA), cola quente, cola instantânea, cola de silicone, etc.
Sigas os passos de como fazer uma colagem bem feita:
1. Escolher: Antes de tudo é preciso escolher a cola mais adequada, essa escolha depende do material a ser colado, por exemplo, por que se usa a mesma cola para colar madeira e papel sendo que estes dois objetos aparentam tanta diferença (o papel é mole e perecível e a madeira é dura e resistente)?. Na verdade, esses objetos possuem em sua composição uma matéria básica em comum: a celulose, até por que a matéria prima para a fabricação de papel é a madeira. Feita a escolha do material é só passar para o 2º passo:
2. Limpar: Fazer uma limpeza criteriosa do local a ser colado é importante, pois sujeiras como poeira e óleos, por exemplo, podem ser prejudiciais no processo.
3. Colar: A cola deve ser adicionada de forma uniforme sobre toda a superfície, é por isso que tem que ser totalmente atraída pelo material a ser colado.
O fato da cola ser atraída pela superfície de contato não basta para uma colagem eficiente. Se você observar criteriosamente uma superfície com a ajuda de um microscópio, vai ver que não é tão lisa como parece a olho nu, pelo contrário, é porosa e irregular. É justamente este aspecto que auxilia o processo, a cola penetra nos orifícios e se adere melhor ao objeto.
Outra pergunta que pode surgir é a seguinte: Por que a cola seca? As colas em geral são líquidas, ou seja, contêm água em sua composição. Quando você cola um objeto e o deixa ao ar livre, ocorre a perda de água (evaporação) da parte líquida da cola.
Sigas os passos de como fazer uma colagem bem feita:
1. Escolher: Antes de tudo é preciso escolher a cola mais adequada, essa escolha depende do material a ser colado, por exemplo, por que se usa a mesma cola para colar madeira e papel sendo que estes dois objetos aparentam tanta diferença (o papel é mole e perecível e a madeira é dura e resistente)?. Na verdade, esses objetos possuem em sua composição uma matéria básica em comum: a celulose, até por que a matéria prima para a fabricação de papel é a madeira. Feita a escolha do material é só passar para o 2º passo:
2. Limpar: Fazer uma limpeza criteriosa do local a ser colado é importante, pois sujeiras como poeira e óleos, por exemplo, podem ser prejudiciais no processo.
3. Colar: A cola deve ser adicionada de forma uniforme sobre toda a superfície, é por isso que tem que ser totalmente atraída pelo material a ser colado.
O fato da cola ser atraída pela superfície de contato não basta para uma colagem eficiente. Se você observar criteriosamente uma superfície com a ajuda de um microscópio, vai ver que não é tão lisa como parece a olho nu, pelo contrário, é porosa e irregular. É justamente este aspecto que auxilia o processo, a cola penetra nos orifícios e se adere melhor ao objeto.
Outra pergunta que pode surgir é a seguinte: Por que a cola seca? As colas em geral são líquidas, ou seja, contêm água em sua composição. Quando você cola um objeto e o deixa ao ar livre, ocorre a perda de água (evaporação) da parte líquida da cola.
Assinar:
Comentários (Atom)